La recente creazione di strutture simil-embrionali umane spinge la società a porsi nuovi interrogativi sull'identità dei prodotti della biologia sintetica: cosa sono queste entità, embrioni o modelli? La risposta però obbliga a rispolverare un'antica questione, mai risolta, riguardo la definizione di embrione per sé: quando un aggregato di cellule che lavora in modo coordinato diventa una vita umana individuale?
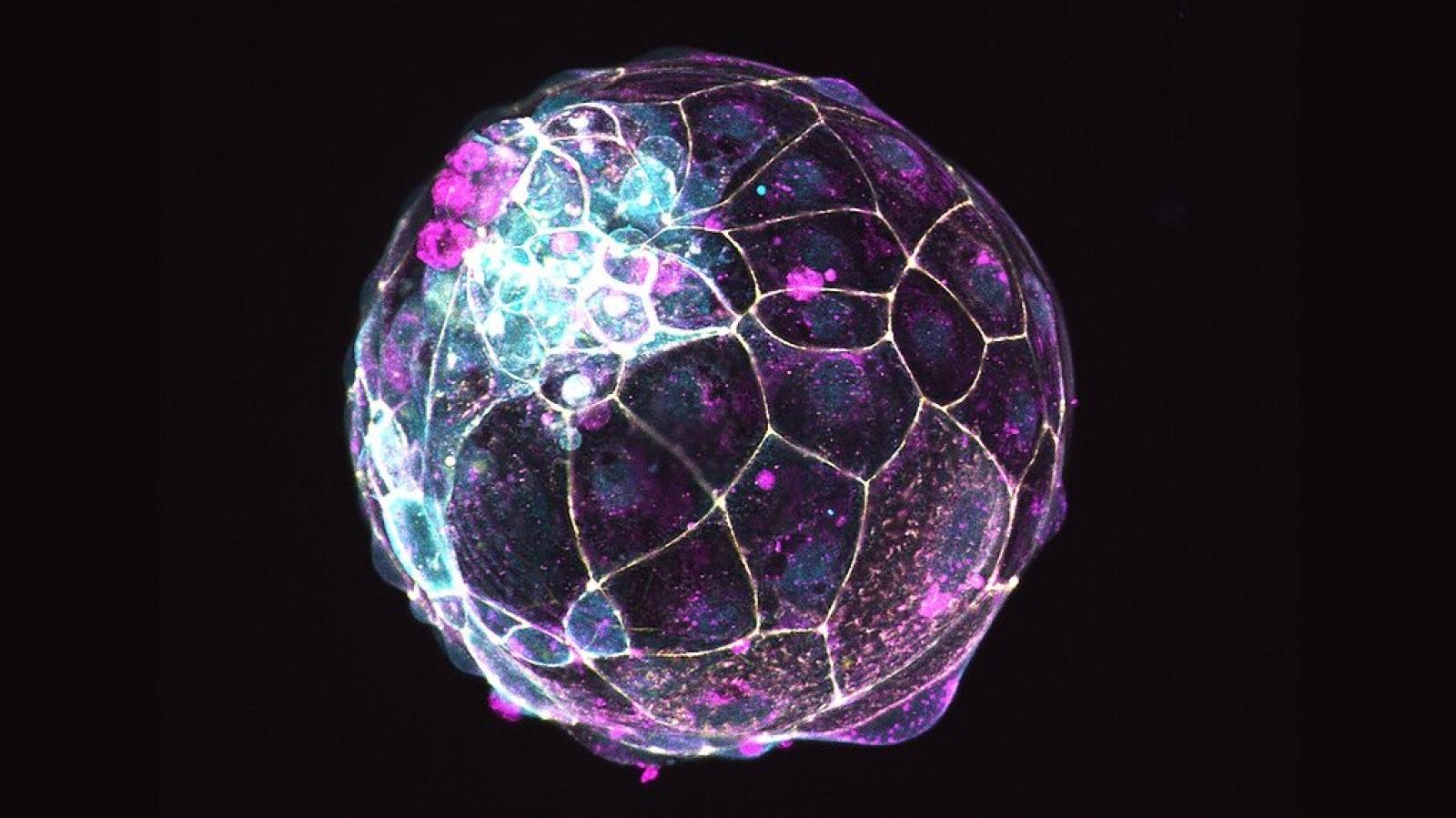
Nell'immagine: blastoide umano derivato da cellule staminali embrionali, marcato per la molecola Z0-1 (giallo) che individua le giunzioni strette tra cellule; per la molecola CDH1 (magenta) che individua le giunzioni aderenti e per la molecola aPKC (ciano) espressa nel dominio apicale. I blastoidi sono strutture modello della blastocisti, una delle prime fasi dello sviluppo dell'embrione.
Crediti immagine: Nicolasrivron, CC BY-SA 4.0 via Wikimedia Commons
Già nel leggerlo, il termine “embrione sintetico” suscita un po’ di inquietudine, figuriamoci se accostato all’aggettivo “umano”. Eppure, lo scorso mese di giugno sembrava proprio che gli embrioni sintetici umani fossero diventati una realtà, almeno così titolavano i media, inneggiando chi alla rivoluzione, chi allo scandalo. Ma che cos’è, e cosa non è, un modello sintetico di embrione umano? Perché il punto è tutto qui: parliamo di modelli, non di embrioni veri e propri.
Tutto comincia il 14 giugno 2023, quando al congresso annuale dell’International Society for Stem Cell Reaserch, Magdalena Zernicka-Goetz, ricercatrice dell’università di Cambridge e del California Institute for technology (Caltech), annuncia di aver messo a punto il modello di embrione umano sintetico mai sviluppato fino a oggi, e rilascia un’esclusiva al giornale britannico the Guardian in cui racconta parte dei risultati ottenuti. «Possiamo creare modelli simili a embrioni riprogrammando cellule staminali embrionali» spiega, e aggiunge che il loro modello è il primo a presentare determinate strutture e caratteristiche embrionali umane. Il Guardian poi esplicita la controversia: «C’è una significativa domanda, ancora senza risposta, rispetto alla potenzialità, teorica, che queste strutture si sviluppino in esseri viventi».
La comunità scientifica però non si sbilancia, prima vuole vedere i dati, così il giorno dopo, il 15 giugno, Zernicka-Goetz pubblica i risultati completi sotto forma di preprint, la versione di un articolo scientifico non ancora controllata da una commissione di pari. Peccato che in quello stesso giorno venga pubblicato anche un altro preprint, dal laboratorio di Jacob H. Hanna del Weizmann Institute of Science in Israele, che mostra risultati simili, se non addirittura più avanzati. «Crescere modelli di embrioni a stadi sempre più avanzati di sviluppo sta diventando una gara altamente competitiva, provocando discussioni sul merito effettivo delle dichiarazioni fatte» avverte Philip Ball, scrittore e giornalista scientifico, in un editoriale della rivista Nature. Una gara accademica e commerciale, che avanza a colpi di brevetto, visto che molti ricercatori attivi nello sviluppo di modelli embrionali da cellule staminali (Zernicka-Goetz e Hanna compresi), hanno domande di brevetto aperte per le tecniche e i protocolli utilizzati. Dichiarazioni rivoluzionarie a parte quindi, che cosa sono effettivamente questi modelli embrionali umani?
Come si crea un modello embrionale umano in laboratorio
Il 27 giugno la rivista scientifica Nature ha pubblicato la versione definitiva dei risultati di Zernicka-Goetz: il gruppo di ricerca ha usato cellule staminali embrionali pluripotenti, quindi in grado di differenziarsi in tutti i tessuti del corpo umano, prelevandole dalla massa interna (una popolazione di cellule che si svilupperanno nel corpo dell’embrione e solo in alcuni tessuti extraembrionali ) di embrioni naturali, derivati dall’unione di uno spermatozoo con una cellula uovo, donati alla ricerca dai centri di fecondazione assistita in quanto non adatti all’impianto in utero. Una volta prelevate, parte di queste cellule sono state riprogrammate geneticamente in maniera da indirizzarne il differenziamento verso le due linee cellulari che, sviluppandosi, formano i tessuti extra embrionali, quali la porzione embrionale della placenta e il sacco vitellino. I ricercatori hanno poi messo insieme queste tre tipologie di cellule (i precursori dei tessuti extraembrionali e le staminali embrionali non trattate che formano l’embrione vero e proprio) e ne hanno osservato il comportamento. Le cellule si sono spontaneamente aggregate e organizzate a formare una struttura tridimensionale molto simile a un embrione umano all’ottavo giorno di sviluppo, quindi poco dopo l’impianto, saltando gli stadi precedenti ed esprimendo alcuni geni distintivi delle popolazioni cellulari e dello stato differenziativo tipici di quella fase. Procedendo con lo sviluppo, gli aggregati di cellule seguivano alcuni processi tipici dell’embriogenesi, fino, in alcuni – rari – casi, alla rottura della simmetria, quel momento fondamentale in cui il futuro embrione specifica quale parte sarà il sopra, quale il sotto e quale estremità sarà il davanti e quale il dietro del corpo. Secondo i ricercatori, queste strutture lasciano intravedere parte dei vari processi di transizione che affronta l’embrione umano durante lo sviluppo.
I risultati di Jacob Hanna sono ancora più avanzati: Bailey Weatherbee, prima autrice del lavoro di Magdalena Zernicka-Goetz, ammette al Guardian che loro non sono arrivati ad avere le strutture presenti nei risultati di Hanna. Il laboratorio di Israele ha impiegato una tecnica simile, usando cellule staminali embrionali umane, ma senza modificarle geneticamente. Il gruppo ha indotto l’espressione transitoria di alcuni marker per indirizzare parte di queste cellule verso destini extraembrionali e dopo averle lasciate aggregare spontaneamente, ha ottenuto delle strutture tridimensionali che ricapitolano l’organizzazione spaziale di tutti i compartimenti dell’embrione al settimo giorno post-fecondazione (subito dopo l’impianto), seguendone poi lo sviluppo fino al quattordicesimo, limite oltre il quale, per legge, non è possibile coltivare embrioni umani nei paesi in cui è consentita la sperimentazione. Gli aggregati hanno mostrato diversi segni distintivi dell’embriogenesi umana, come la rottura della simmetria, qui ottenuta nella maggior parte dei casi, la formazione del disco bilaminare e l’espressione di diversi geni che hanno validato la composizione e l’identità delle popolazioni cellulari in via di differenziamento. L’obiettivo, chiariscono i ricercatori nella discussione del paper, è quello di costruire un modello che mostri le principali strutture e i processi fondamentali dell’embriogenesi, non creare qualcosa che sia uguale a un embrione. E questo è il punto fondamentale.
Cosa distingue un modello da un embrione
Viste le incredibili somiglianze tra le strutture ottenute dai due laboratori e un embrione umano vero e proprio, ci si potrebbe chiedere invece: quanto sono diversi? Tanto.
Per riassumere, secondo la visione piuttosto critica, espressa su twitter e al Science Media Center di Alvaro Martinez Arias, biologo dello sviluppo dell’università Pompeu Fabra di Barcellona, quelle di Magdalena Zarnicka-Goetz sono «strutture debolmente organizzate di cellule diverse» e «non c’è nulla in quei risultati da poter considerare analogo all’embrione. È un lavoro iniziale». Critica drastica a parte, vero è che l’articolo scientifico stesso evidenzia i limiti dei risultati: le strutture mancano di alcune popolazioni cellulari, altre hanno un’espressione molto diversa dei geni e nella maggior parte dei casi, l’epiblasto, una struttura cellulare da cui derivano il sacco amniotico e il corpo dell’embrione, si differenzia solo in sacco amniotico. «Mancano ancora molte informazioni» commenta Carlo Alberto Redi, professore all’università di Pavia e presidente del comitato etico della Fondazione Umberto Veronesi, «Non sappiamo nulla dei marker epigenetici per esempio», le modificazioni del DNA che contengono diverse informazioni per il differenziamento cellulare. Anche il gruppo di Hanna chiarisce che le strutture ottenute ricapitolano solo parte delle caratteristiche e dei processi dell’embrione umano.
Ulteriori conferme di queste differenze provengono dai dati nel mondo animale: nel 2022, sia il laboratorio di Hanna che quello di Zernicka-Goetz hanno pubblicato i risultati di modelli di embrioni di topo ottenuti con tecniche analoghe alla versione umana, che però hanno potuto lasciar sviluppare per più tempo. In entrambi i casi, le cellule staminali di partenza si sono autoassemblate a formare strutture simil-embrionali e sono andate incontro a una prima organogenesi. I modelli presentavano delle formazioni cerebrali precoci (prosencefalo e mesencefalo), una struttura pulsante simile al cuore, il tubo digestivo e i somiti. Lo sviluppo però non è progredito oltre gli 8,5 giorni (equivalente alla terza settimana di sviluppo nell’uomo), nonostante il sistema di coltura avesse provato di poter mantenere un embrione di topo fino all’undicesimo giorno di sviluppo. Inoltre, parte delle cellule presentavano un’espressione genetica aberrante, così come parte delle strutture, per esempio i proto-cuori avevano dimensioni anomale.
I modelli animali hanno permesso inoltre di testare l’impianto. Le strutture di Hanna e di Zernicka-Goetz rappresentano una fase dello sviluppo embrionale post-impianto, ma vi sono altri modelli di embriogenesi integrata (ovvero che hanno tutte le popolazioni cellulari iniziali per poter costituire, in potenza, un embrione completo) che simulano l’embrione in una fase pre-impianto (blastocisti) e con cui quindi si può testare questo processo. I risultati più recenti arrivano dalla scimmia: lo scorso aprile, il gruppo di Zhen Liu dell’Accademia Cinese delle Scienze di Shanghai, ha ottenuto dei blastoidi, modelli di blastocisti, da cellule staminali embrionali di macaco, e le ha lasciate sviluppare per venti giorni. Al diciassettesimo giorno, la maggior parte delle strutture (481 su 485) si erano disgregate e quelle impiantate al sesto giorno in otto femmine avevano indotto dei primi sintomi di gravidanza in tre esemplari, scomparendo però dopo una settimana dall’impianto, senza mai svilupparsi oltre. Visti i dati, è d’obbligo domandarsi se il termine “embrione sintetico” non sia piuttosto prematuro.
Nonostante gli apparenti fallimenti è chiaro però che la comunità scientifica è alla ricerca di un modello, umano o animale, che pur non essendo uguale a un embrione, ne simuli parte dei processi di sviluppo e ci fornisca degli indizi su come un essere vivente si costituisce. E la motivazione è semplice: ne abbiamo bisogno.
Perché abbiamo bisogno di modelli embrionali
Il 60% delle gravidanze fallisce nella seconda settimana dopo l’impianto nell’utero e la metà degli embrioni non riesce neanche a impiantarsi. Comprendere le cause degli aborti spontanei è solo una delle ragioni che motivano la ricerca scientifica a cercare un modello che simuli i meccanismi dell’embriogenesi. Al settimo giorno dalla fecondazione, l’embrione si impianta nell’utero e gli scienziati rimangono al buio: la “scatola nera dello sviluppo”, così viene chiamato il periodo che segue l’impianto, soprattutto superato il quattordicesimo giorno, quando inizia la gastrulazione, il processo che disegna i primi schemi corporei dell’embrione, e quando, per legge, non è più possibile coltivare embrioni umani nei Paesi che consentono la sperimentazione.
Il guadagno di conoscenze che deriverebbe dall' “aprire” questa scatola permetterebbe di studiare l’impatto di diverse malattie genetiche manipolando i geni, e testare la sicurezza di farmaci o determinare quando e a quali concentrazioni è meglio somministrare sostanze come l’acido folico, fondamentale per il corretto sviluppo del sistema nervoso in gravidanza. E non solo: «Vedere questi meccanismi dispiegarsi ci darebbe indizi importanti sulla formazione degli organi» spiega Jacob Hanna in un’intervista al Washington Post, «Stiamo affrontando delle difficoltà nel fare gli organi, e per capire come far diventare cellule staminali degli organi, dobbiamo capire come li fa l’embrione», accelerando così la ricerca nella medicina rigenerativa. Allo stesso modo, ne beneficerebbero le tecniche che impiegano cellule staminali adulte: «Aumentare le nostre conoscenze sui processi differenziativi aiuterebbe a ottimizzare i protocolli esistenti per il lavoro con le staminali» commenta Redi «E in modo collaterale, capire i meccanismi di pluripotenza fornirebbe indizi utili per comprendere e rispondere ad alcuni comportamenti delle cellule tumorali».
La controversia etica
Anche se per ora sono solo modelli, lo sviluppo di queste strutture simil-embrionali obbliga tuttavia a una riflessione: per quanto diversi da un embrione, questi modelli ne possiedono, o possederanno, determinate caratteristiche, sufficienti forse a dotarli di un proprio status morale? Riflessione che a sua volta rialimenta l’annosa questione dello statuto dell’embrione: quando un aggregato di cellule che lavorano in modo coordinato diventa una vita umana individuale? Cosa definisce un embrione: lo stadio di sviluppo, l’origine da gameti o la possibilità di svilupparsi in un essere umano? È evidente come non ci sia una singola risposta unanime e «Questo si riflette su una legislazione internazionale a macchia di leopardo, dove ogni stato definisce e tutela l’embrione a modo proprio» evidenzia Demetrio Neri, professore emerito di bioetica all’università di Messina e membro della Consulta di bioetica, con sede a Torino.
Una corrente di pensiero vede lo statuto morale di un’entità vivente aumentare al progredire dello sviluppo, così permettendo di delineare dei limiti, morali e legali, entro i quali per esempio, condurre la ricerca scientifica. La regola dei 14 giorni ne è un risultato: negli anni ’80, dopo la prima fecondazione in vitro, c’era la necessità di regolamentare la conservazione e l’impiego degli embrioni non adatti all’impianto. Viene proposto un limite di 14 giorni, oltre il quale non è permesso tenere in coltura un embrione umano. La scelta, arbitraria, ricade sul quattordicesimo giorno perché coincide con la formazione della stria primitiva, una struttura embrionale che segna l’inizio alla gastrulazione: i distretti del corpo iniziano a formarsi, l’embrione non può più dividersi in due gemelli, né due gemelli possono fondersi in un unico embrione; è un’entità definitivamente individuale. Ma tanto al tempo nessuno era riuscito a coltivare un embrione per più di cinque giorni: il problema non si dava.
Oggi, non solo la tecnica non è più limitante, ma sono apparse nuove entità biologiche che necessitano di essere definite e regolamentate. Seppur intesi come modelli, i laboratori devono rispettare la regola dei 14 giorni? Ha senso applicare questa regola se queste strutture non seguono un’embriogenesi canonica, saltando determinati stadi di sviluppo, potenzialmente bypassando la formazione della stria primitiva? Nel 2017, alcuni professori di Harvard esplicitavano questi dubbi, suggerendo che la regola dei 14 giorni venisse rivista e proponendo che i limiti di sviluppo venissero decisi collettivamente, dalla comunità scientifica e dall’opinione pubblica, in base a strutture o caratteristiche che i modelli mostrassero di acquisire, definite “moralmente problematiche”: per esempio, la formazione di un circuito funzionale nervoso di percezione dolorosa. Nel 2021, l’international Society of Stem Cell Research ha pubblicato le nuove linee guida, in cui invita ad allentare la restrizione a 14 giorni con la proposta di valutare gli esperimenti sui modelli integrati caso per caso, lasciando il divieto di impianto di qualsiasi modello umano.
La biologia sintetica obbliga a porci nuove domande, inimmaginabili fino a poco tempo fa: «La scienza progredisce più veloce della legge. Dobbiamo ripensare l’immagine del corpo umano, perché quella a cui siamo abituati non funziona più» commenta Neri. Le nuove tecnologie hanno bisogno di essere accompagnate «per una politica che non limiti la scienza, ma la indirizzi e la governi». Certo è che l’Italia taglia la testa al toro, impedendo qualsiasi tipo di sperimentazione sull’embrione umano che non sia mirata alla salute dello stesso. Peccato che al contempo, non definisca mai cosa è un embrione.